ФИЗИОЛОГИЯ ЭЯКУЛЯЦИИ: СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ
(ОБЗОР ЛИТЕРАТУРЫ)
Г. С. Кочарян
Харьковская медицинская академия последипломного образования
Представлены современные данные о физиологии эякуляции.
Ключевые слова: эякуляция, физиология, современные представления.
Эякуляция представляет собой рефлекторный акт, в который вовлечены сенсорные рецепторы и области, афферентные пути, мозговые сенсорные области, мозговые двигательные центры, спинальные двигательные центры и эфферентные пути [15]. Эякуляция начинается с активного мышечного сокращения семявыносящих протоков и разделяется на 2 фазы – эмиссию и изгнание. Она в подавляющем числе случаев сопряжена с фазой оргазма (см. рис.).
В фазе эмиссии семявыносящие протоки, простата и семенные пузырьки начинают сокращаться, и семенная жидкость поступает в простатическую (заднюю) часть уретры (pars prostatica urethrae).
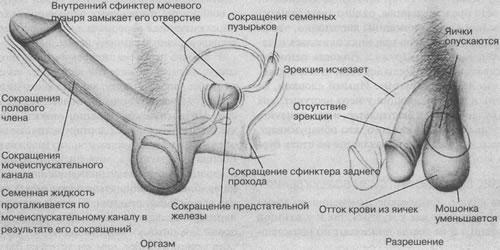
Рис. Внешние и внутренние изменения, сопровождающие цикл сексуальной реакции у мужчины [по 1].
Поступление эякулята в эту часть уретры, действуя как стимулятор парасимпатической и соматической иннервации, вызывает вторую фазу – фазу изгнания (выбрасывания, извержения). Эмиссия – результат спинномозгового рефлекса, инициированного генитальными и/или церебральными эротическими стимулами. Значительный начальный волевой контроль эмиссии прогрессивно уменьшается по мере достижения эякуляторной неизбежности [27]. Фаза эмиссии осуществляется при посредничестве адренергической системы и реализуется благодаря норэпинефрину и другим местным нейротрансмиттерам – окситоцину (Maggi et al., 1987), эндотелину (Peri et al., 1997) и аденозин-5-трифосфату (АТР) (Mulryan et al., 2000) [по 2].
Изгнание семени из уретры происходит в результате серии ритмичных сокращений (продолжительностью 0,8 с) ишиокавернозной, бульбоспонгиозной мышц в содружестве с другими мышцами промежности. После первых 3–4 сокращений промежутки между ними увеличиваются, а их интенсивность уменьшается [1]. В этой стадии также отмечается неустойчивое расслабление внешнего сфинктера уретры [19].
Во время выброса спермы шейка мочевого пузыря плотно закрыта, благодаря чему исключается ретроградная эякуляция (заброс спермы в мочевой пузырь).
Анатомо-функциональным центром, запускающим эякуляторный рефлекс, является совокупность вегетативных нейронов боковых рогов и моторных нейронов передних рогов спинного мозга, объединенных одной функциональной задачей и называемых спинальным центром эякуляции.
Симпатические нейроны контролируют фазу эмиссии эякуляторного рефлекса, а фаза изгнания регулируется соматическими и вегетативными (парасимпатическими) моторными нейронами.
Первая фаза эякуляции совершается непроизвольно под действием симпатических импульсов, следующих из сегментов Th12–L4 [17, 21, 23]. Вторая фаза эякуляции совершается более энергично, так как в ней к действию парасимпатических импульсов, следующих из сегментов S2–S4 и воздействующих на гладкую мускулатуру семенных пузырьков и предстательной железы, присоединяются импульсы, приводящие к мощным сокращениям поперечнополосатой мускулатуры, начинающимся с m. constrictor urethrae, mm. bulbocavernosi и mm. ischiocavernosi, в которые вовлекается вся произвольная и непроизвольная мускулатура тазового дна. По данным R. Kafemann (1914), действие аппарата эякуляции у отдельных лиц достигает такой силы, что семенная жидкость извергается на расстояние более метра [по 3].
Эякуляторный рефлекс преимущественно контролируется сложным взаимодействием между центральными серотонергическими и допаминергическими нейронами с вторичным вовлечением холинергических (cholinergic), адренергических (adrenergic), нитрергических (nitrergic), окситоцинергических (oxytocinergic), галанергических (galanergic) и габаергических (GABAergic) нейронов. (GABA – аббревиатура, составленная из начальных букв слов γ-aminobutyric acid [γ-аминомасляная кислота].)
Мозговые процессы, которые происходят во время эякуляции, и отклонения у мужчин с преждевременной эякуляцией (ПЭ) не были «ясно определены» с помощью позитронно-эмиссионной томографии (positron emission tomography; PET) и функциональной магниторезонансной томографии (functional magnetic resonance imaging; fMRI) [15].
Эмиссия спермы и ее изгнание объединены в сложный паттерн несколькими структурами переднего мозга, включая среднюю предоптическую область (the medial preoptic area; MPOA) и парагигантоклеточное ядро (the nucleus paragigantocellularis; nPGi) [20, 28].
Нисходящие серотонергические пути от nPGi к люмбосакральным моторным ядрам тонически задерживают/подавляют эякуляцию [28]. Дезингибирующее влияние на nPGi, которое оказывает MPOA, облегчает наступление семяизвержения. У крыс-самцов была идентифицирована популяция поясничных спиноталамических нейронов (lumbar spinothalamic neurons; LSt cells), которые участвуют в генерировании эякуляции. Эти клетки посылают сигналы автономным ядрам и мотонейронам, вовлеченным в эмиссию и изгнание, и получают сенсорные сигналы из области таза [24]. Изучение источников литературы, которое было проведено в последнее время, подтвердило роль LSt cells в регуляции эякуляции [29].
Несколько мозговых областей активируются после эякуляции восходящими волокнами из спинного мозга и могут играть роль в насыщении и наступлении постэякуляторного рефрактерного периода [15].
Основываясь на клинических наблюдениях, Уайтло и Смисуик предлагают следующую схему иннервационного обеспечения эякуляции, которая приведена ниже [по 3].
В фазе эмиссии оргазма как такового еще нет, за 2–4 с до выброса эякулята из пениса возникает лишь ощущение его (выброса) неотвратимости. Психосенсорным эквивалентом фазы изгнания является острое переживание оргазма, которое происходит синхронно с энергичными мышечными спазмами поперечнополосатых мышц [14].
Несмотря на приведенные выше данные об участии спинного мозга в обеспечении семяизвержения, наиболее распространено мнение, что спинномозговой центр эякуляции расположен в L1–L3. Помимо этого, считается, что он, по-видимому, не имеет такой же четкой локализации в спинном мозге, как центр эрекции.
J. P. Wolters, W. J. Hellstrom [26] в своей статье, ссылаясь на результаты исследований различных авторов, обсуждают проблему регуляции эякуляции. Они отмечают, что специализированными супраспинальными церебральными структурами, ингибирующими эякуляцию, являются posteromedial bed nucleus полоски мозгового вещества (stria terminalis), posterodorsal medial amygdaloid nucleus, posterodorsal preoptic nucleus и мелкоклеточная часть субпарафасцикулярного таламуса (the parvicellular part of the subparafascicular thalamus) [16].
ЭЯКУЛЯЦИЯ
Прямое тактильное раздражение Психическое возбуждение
полового члена высших отделов мозга
l l
Срамной нерв Межуточный мозг
l
Спинной мозг
l
Суммация тактильных и психических возбуждений, порождающих так
называемый оргазм
l
Поясничный центр
l l
Симпатическая реакция Парасимпатическая реакция
l l
Сокращение гладких мышц Сокращение поперечно-
простаты, семенных пузырьков полосатых, седалищно-
и семявыносящих протоков. пещеристых, луковично-
Замыкание внутреннего сфинктера пещеристых мышц
мочевого пузыря и m. constrictor urethrae
l l
Фаза выведения Фаза выбрасывания
В регуляцию эякуляторного рефлекса вовлекаются различные медиаторные (нейротрансмиттерные) системы спинальной и супраспинальной локализации. Наиболее важную роль, по-видимому, играют центральные серотонергические и допаминергические нейроны [13]. Ацетилхолин, адреналин, нейропептиды, окситоцин, γ-aминомасляная кислота и окись азота играют второстепенную/вспомогательную роль [6]. Многофакторная и сложная природа эякуляторного рефлекса, однако, делает определение точной роли каждого отдельного нейротрасмиттера (медиатора) чрезвычайно трудным.
Уровни допамина в средней предоптической области гипоталамуса прогрессивно увеличиваются в течение возбуждения во время полового акта. Таким образом, допамин вовлечен в физиологию сексуального возбуждения и оргазма [13]. Было показано, что у животных антагонисты рецепторов γ-aминомасляной кислоты оказывают ингибирующий эффект на сексуальное поведение, а мышечные сокращения во время эякуляции, по-видимому, опосредуются окситоцином [6].
Наиболее изученный медиатор (нейротрасмиттер), участвующий в регуляции эякуляции, – серотонин (5-hydroxytryptamine; 5-HT) [6, 25]. Если ранее сообщалось, что идентифицировано 14 разных подтипов рецепторов 5-HT, каждый из которых имеет различную нейроанатомическую локализацию и функцию [18], то позже появились данные, что в настоящее время известно около 15 видов серотониновых рецепторов, однако далеко не все их виды и подвиды встречаются в головном мозге человека [4].
5-HT нейроны содержат соматодендритные ауторецепторы (5-HT1а), предсинаптические ауторецепторы (5-HT1b, 5-HT1d), сигнализирующие рецепторы (5-HT2c) и транспортеры обратного захвата (reuptake transporters). Каждый из названных рецепторов опосредует различные аспекты клеточной активации 5-HT системы и передачи ею сигналов [9]. (Ауторецептор – рецепторная молекула нейрона, которая реагирует на нейротрансмиттер, вырабатываемый самим нейроном.)
Cоматодендритные ауторецепторы 5-HT1а, которые присутствуют в ядрах среднего мозга и мозгового шва (mesencephalic и medullary raphe nuclei), являются ответственными как за уменьшение высвобождения серотонина в синапс через отрицательный механизм обратной связи, что приводит к уменьшению его уровня в синаптической щели, так и за уменьшение латентного периода эякуляции (ejaculatory latency) [7, 10].
5-НТ2а-рецепторы обнаружены и в центральной нервной системе человека. Их большая плотность отмечается в пирамидальных нейронах в большинстве регионов коры головного мозга, скорлупе, базальных ганглиях, а меньшая – в гиппокампе и хвостатом ядре. Считается, что данный вид рецепторов участвуют в формировании полового поведения человека [4].
Рецепторы 5-HT1b и 5-HT2c, в отличие от предсинаптических 5-HT1а ауторецепторов, присутствуют в постсинаптической мембране. И те и другие увеличивают латентное время эякуляции. Мнение о том, что стимуляция 5-HT2c рецепторов неселективными агонистами задерживает эякуляцию у крыс-самцов, тогда как возбуждение постсинаптических рецепторов 5-HT1a приводит к более короткому латентному периоду эякуляции, высказывалось и ранее на основании экспериментов с самцами крысы [5]. У крыс 5-НТ2с-рецепторы обнаружены в наибольшем количестве в хориоидальном сплетении, гиппокампе, полосатом теле, черной субстанции [4].
Зависимость между концентрацией серотонина в синаптической щели и латентным периодом эякуляции подтверждается доказанной эффективностью ингибиторов обратного захвата серотонина в лечении преждевременной эякуляции, которые увеличивают уровень серотонина в синапсе [19].
Учитывая отношения между серотонергическими рецепторами и их ингибирующими и стимулирующими эффектами, вероятно, что патофизиологический механизм эякуляторных расстройств связан с изменением количества или измененной чувствительностью 5-HT рецепторов в регулирующих эякуляторных центрах центральной нервной системы [7]. Отмечается, что хотя эта гипотеза нуждается в дальнейшем изучении, неустойчивость синаптической концентрации 5-HT и измененная сенситивность рецепторов могут обеспечить патофизиологический базис многих расстройств эякуляции [26].
Многие исследования выявили центральное посредничество агониста 8-hydroxy-2-di-npropylamino-tetralin (8-OH-DPAT) в воздействии на 5-HT1а рецепторы. Этот агонист вызывает ПЭ у самцов крысы [11, 12, 22]. (Агонист – эндогенное вещество или лекарство, которое может взаимодействовать с рецепторами и инициировать физиологические или фармакологические характеристики отклика рецептора.)
Р. Clément et al. [8], которые создавали состояния, подобные преждевременной эякуляции (PE-like conditions) у животных, установили, что 8-OH-DPAT оказывает дозозависимый проэякуляторный эффект на бульбоспонгиозную мышцу (m. bulbospongiosus), который усиливает ее сократимость и изгнание спермы. В их экспериментах к мозговым желудочкам крыс стереотаксически были подведены канюли для центрального дозирования препарата. Применение 5-HT1а антагониста WAY100635, который вводился таким же образом, не смогло полностью противодействовать влиянию 8-OH-DPAT. Кстати, введение антогонистов допаминовых D2-рецепторов (raclopride и spiperone) значительно уменьшало сокращения бульбоспонгиозных мышц и таким образом пролонгировало латентное время эякуляции. Было показано, что quinelorane – агонист рецепторов, подобных D2-рецепторам (D2-like receptors), вызывает ритмичные сокращения бульбоспонгиозных мышц. Полученные результаты, отмечают авторы, – верный признак, что рецепторы, подобные D2-рецепторам, играют в ЦНС интегральную роль в эякуляторном ответе. Исследователи пришли к заключению, что эти рецепторы также важны для опосредования эякуляции, как и 5-HT1а рецепторы, если не более. Поэтому, по их мнению, в будущем фармакологические манипуляции относительно эякуляторного рефлекса должны будут больше сосредоточиться на рецепторах, подобных D2-рецепторам.
В заключение следует отметить, что, как следует из приведенных выше данных, физиологическая регуляция эякуляции является довольно сложной.
Фізіологія еякуляції: сучасні уявлення (огляд літератури)
Г. С. Кочарян
Представлені сучасні дані щодо фізіології еякуляції.
Ключові слова: еякуляція, фізіологія, сучасні уявлення.
Physiology of ejaculation: modern data (the review of literature)
G. S. Kocharyan
Мodern data on the physiology of ejaculation are presented.
Keywords: ejaculation, physiology, modern data.
- ЛІТЕРАТУРА
- Мастерc У., Джонсон В., Колодни Р. Основы сексологии / Пер. с англ. – М.: Мир, 1998. – х. + 692 с.
- Нарушение эякуляции // http://norm-urolog.narod.ru/nar.html.
- Общая сексопатология. Руководство для врачей / Под ред. Г. С. Васильченко. – М.: Медицина,1977. – 488 с.
- Серотонинергическая система // http://psychiatry.narod.ru/ art_2.html
- Ahlenius S., Larsson K., Svensson L., Hjorth S., Carlsson A., Lindberg P., Wikström H., Sanchez D., Arvidsson L. E., Hacksell U., Nilsson J. L. // Effects of a new type of 5-HT receptor agonist on male rat sexual behaviour // Pharmacol Biochem Behav. – 1981. – 15 (5). – Р. 785–792.
- Bitran D., Hull E. M. Pharmacological analysis of male rat sexual behavior // Neurosci Biobehav Rev. – 1987. – 11 (4). – P. 365–389.
- Cantor J. M., Binik Y. M., Pfaus J. G. Chronic fluoxetine inhibits sexual behavior in the male rat: reversal with oxytocin. Psychopharmacology (Berl) // 1999. – 144. – Р. 355–362.
- Clément P., Bernabé J., Kia H. K., Alexandre L., Giuliano F. D2-like receptors mediate the expulsion phase of ejaculation elicited by 8-hydroxy-2-(di-N-propylamino) tetralin in rats // J Pharmacol Exp Ther. – 2006. – 316 (2). – Р. 830–834.
- Frank J. L., Hendricks S. E., Olson G. H. Multiple ejaculations and chronic fluoxetine: effects on male rat copulatory behavior // Pharmacol Biochem Behav. – 2000. – 66 (2). – P. 337–342.
- Giuliano F., Clement P. Serotonin and premature ejaculation: from physiology to patient management // Euro Urol. – 2006. – 50. – Р. 454–466.
- Haensel S. M., Mos J., Olivier B., Slob A. K. Sex behavior of male and female Wistar rats affected by the serotonin agonist 8-OH-DPAT // Pharmacol Biochem Behav. – 1991. – 40. – P. 221–228.
- Hillegaart V., Ahlenius S. Facilitation and inhibition of male rat ejaculatory behaviour by the respective 5-HT1A and 5-HT1B receptor agonists 8-OH-DPAT and anpirtoline, as evidenced by use of the corresponding new and selective receptor antagonists NAD-299 and NAS-181 // Br J Pharmacol. – 1998. – 125 (8). – P. 1733–1743.
- Hull E. M., Du J., Lorrain D. S., Matuszewich L. Extracellular dopamine in the medial preoptic area: implications for sexual motivation and hormonal control of copulation // J Neurosci. – 1995. – 15 (11). – P. 7465–7471.
- Masters W. H., Johnson V. E. Human sexual response. – Boston: Little, Brown and Co., 1970. – 467 p.
- McMahon C. G. Premature ejaculation // Indian Journal of Urology. – 2007. – Volume 23, Issue 2. – P. 97–108.
- Meisel R. L., Sachs B. D. The physiology of male sexual behavior // Knobil E., Neill J. D (Eds.). The Physiology of Reproduction. – 3rd ed. – New York: Raven Press, 2005. – P. 3–105.
- Munro D., Horne H. W. Jr., Paull D. P. The effect of injury to the spinal cord and cauda equina on the sexual potency of men // New Eng. J. Med. – 1948. – Vol. 239. – P. 903–911.
- Pandey S. C., Davis J. M., Pandey G. N. Phosphoinositide system-linked serotonin receptor subtypes and their pharmacologic properties and clinical correlates // J Psychiatry Neurosci. – 1995. – 20. – P. 247–250.
- Premature ejaculation // http://psychology.wikia.com/wiki/Premature_ejaculation
- Robinson B. W., Mishkin M. Ejaculation evoked by stimulation of the preoptic area in monkeys // Physiol Behav. – 1966. – 1. – Р. 269–272.
- Rose Т. F. Sudeck’s post-traumatic osteodystrophy of limbs // Med. J. Aust. – 1953. – N 1. – P. 185–188.
- Schnur S. L., Smith E. R., Lee R. L., Mas M., Davidson J. M. A component analysis of the effects of DPAT on male rat sexual behavior // Physiol Behav. – 1989. – 45 (5). – P. 897–901.
- Semans J. H., Langwortliy O. R. Observations on neurophysi-ology of sexual function in male cat // J. Urol. – 1938. – Vol. 40. – P. 836–840.
- Truitt W. A., Coolen L. M. Identification of a potential ejaculation generator in the spinal cord // Science. – 2002. – 297 (5586). – Р. 1566–1569.
- Waldinger M. D., Berendsen H., Blok B. F. et al. // Premature ejaculation and serotonergic antidepressantsinduced delayed ejaculation: the involvement of the serotonergic system // Behav Brain Res. – 1995. – 92. – P. 111–118.
- Wolters J. P., Hellstrom W. J. Current concepts in ejaculatory dysfunction // Rev Urol. – 2006. – 8, Suppl. 4. – P. 18–25.
- Yeates W. K. Chp.10-Ejaculatory disturbances // Pryor J. P., Lipschultz L. (Eds.). Andrology. – London: Butterworths, 1987. – P. 183–216.
- Yells D. P., Hendricks S. E., Prendergast M. A. Lesions of the nucleus paragigantocellularis: effects on mating behavior in male rats // Brain Res 1992. – 596 (1–2). – Р. 73–79.
- Young B., Coolen L., McKenna K. Neural regulation of ejaculation // J Sex Med. – 2009. – 6, Suppl. 3. – Р. 229–233.
Библиографические данные о статье: Кочарян Г. С. Физиология эякуляции: современные представления (обзор литературы) / Г. С. Кочарян // Здоровье мужчины. – 2014. – №4 (51). – С. 18–20.
Общие сведения об авторе, его статьи и книги (в свободном доступе) представлены на его персональном веб-сайте gskochar.narod.ru